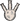
Электрохимия — это раздел химии, в котором рассматриваются системы при протекании через них электрического тока (упорядоченного движения заряженных частиц, которые могут встречаться в веществе), исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). В металлах за возникновение тока отвечают электроны, которые как бы «мигрируют» от одного атома металла к другому в металлической решетке.
В растворах ток возникает за счет движения как положительно, так и отрицательно заряженных частиц (катионов (+) и анионов (-)). Так, дистиллированная вода плохо проводит ток, поскольку в ней практически отсутствуют заряженные частицы, но если сделать так, чтобы в растворе эти частицы появились (например, растворить в воде поваренную соль NaCl, которая диссоциирует на катионы Na+ и Cl-), то ток будет проводиться данной системой гораздо лучше.

Металлическая решетка
Электролизом называется окислительно-восстановительный процесс (процесс, связанный с передачей электронов), который происходит при пропускании электрического тока через раствор или расплав какого-либо вещества
Упорядоченное движение ионов (заряженных частиц) в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединенными с полюсами источника электрической энергии.
-
 Катодом при электролизе называется отрицательный электрод
Катодом при электролизе называется отрицательный электрод -
 Анодом называется положительный электрод
Анодом называется положительный электрод
Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду
Несмотря на простоту практического осуществления, записать уравнения химических реакций, протекающих при электролизе водных растворов, труднее, чем в случае электролиза расплавов. Объясняется это тем, что при электролизе водных растворов в реакции могут участвовать не только ионы электролита, но и молекулы воды.
При электролизе водного раствора соли или щелочи на катоде в зависимости от активности восстанавливающегося металла возможны следующие реакции:
-
 Восстановление катионов металла:
Восстановление катионов металла:

-
 Восстановление водорода из воды:
Восстановление водорода из воды:

Легче всего восстанавливаются наименее активные металлы, расположенные в ряду активности правее водорода. Наиболее активные металлы являются сильными восстановителями, поэтому обратный процесс — восстановление активных металлов из соединений — осуществить сложно. В связи с этим при электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Для металлов со средней химической активностью, расположенных в ряду активности после алюминия, на катоде происходят одновременно две реакции: образование водорода и выделение металла
При электролизе водного раствора соли или щелочи на аноде в зависимости от природы аниона возможны следующие реакции:
-
 Окисление анионов, образующихся при диссоциации соли:
Окисление анионов, образующихся при диссоциации соли:

-
 Окисление воды:
Окисление воды:

Электрохимия создала электрохимические источники тока: батарейки и аккумуляторы. Принцип действия аккумулятора основан на обратимости химической реакции. Электрохимические аккумуляторы (ЭХА) в процессе заряда преобразуют электрическую энергию в химическую, а в процессе разряда — химическую энергию в электрическую.
Основу электрохимических источников тока составляют два электрода (анод, содержащий окислитель, и катод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции.
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделенных процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.

Наиболее перспективными для энергетики являются натриевые, литиевые и воздушноцинковые аккумуляторы.
Дополнительные материалы
-
 Ролик на YouTube от MEL Chemistry.
Ролик на YouTube от MEL Chemistry. -
 «Электрохимия. Учебное пособие», Дамаскин, Петрий, Цирлина.
«Электрохимия. Учебное пособие», Дамаскин, Петрий, Цирлина. -
 Ролик на YouTube от MEL Chemistry.
Ролик на YouTube от MEL Chemistry. -
 Статья про электрохимию на «Википедии».
Статья про электрохимию на «Википедии». -
 Статья про электрохимические батареи.
Статья про электрохимические батареи. -
 Статья про электролиз.
Статья про электролиз.
Благодарим за предоставленное для съемок оборудование MEL Science
Для школьников 5−9 классов и их родителей
Химия вокруг нас
В этом курсе автор расскажет вам о базовых принципах химии, используя вещества, с которыми мы сталкиваемся ежедневно: еду, соки, моющие средства, разные виды пластика. После каждой лекции нужно будет выполнить небольшое практическое задание, реактивы для которого вы сможете найти у себя дома или в ближайшем магазине.

20 уроков с заданиями

Авторская подача: просто, понятно и c юмором

Свободное расписание: нет дедлайнов и сроков сдачи заданий

Все материалы доступны сразу, можно начать обучение в удобное время

Практические задания после каждого урока

Профессиональное видео и современная графика

Быстрая связь с техподдержкой и чат с автором

Сертификат о прохождении курса
Зачем

Научиться печь шарлотку, используя реакцию Майяра

Развить внимание, воображение и научное мышление

Расширить кругозор и задуматься о природе вещей
Что вы получите
Запишитесь на курс, чтобы общаться в чате с преподавателем, выполнять задания и получить сертификат. Вы получите доступ немедленно. Это бесплатно.

Новинка. Курс создан в 2021 г.

Узнать о бережном отношении к природе и экологии

Увидеть другой подход к преподаванию
Находясь на сайте, вы даете согласие на обработку файлов cookie. Это необходимо для более стабильной работы сайта